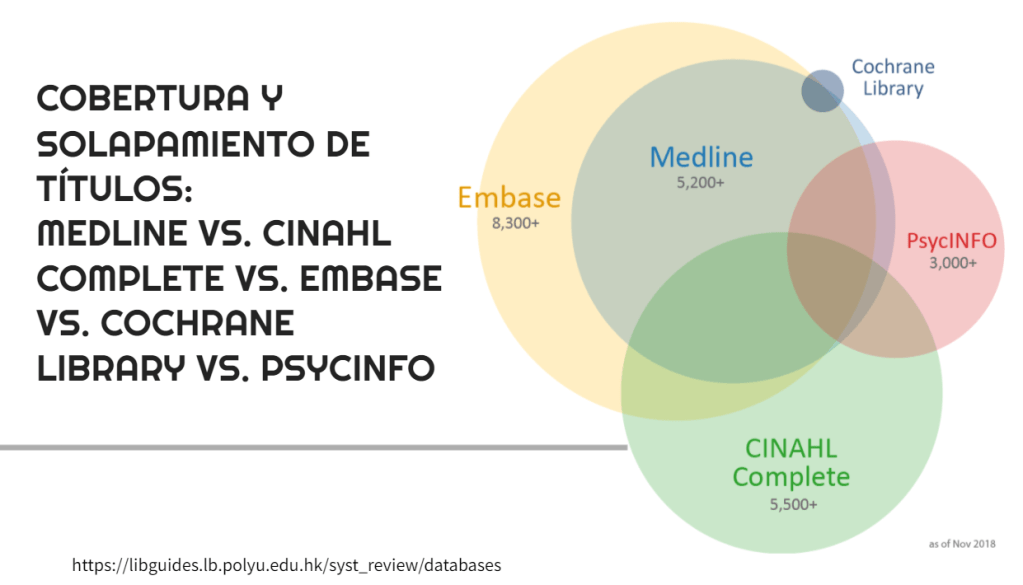
La declaración PRISMA 2009 indicaba que la sección de conclusiones de una revisión sistemática debe «proporcionar una interpretación general de los resultados en el contexto de otras evidencias» (1). En la actualización, PRISMA 2020 añade «argumente las implicaciones de los resultados para la práctica, las políticas y las futuras investigaciones» (2). Sin embargo, la declaración no requiere que los autores de revisiones sistemáticas hagan recomendaciones dentro de esta sección.
Las directrices de la Colaboración Cochrane (3) y del grupo de trabajo GRADE (4) establecen específicamente que las revisiones sistemáticas no deben incluir recomendaciones para la práctica. Así, podemos leer en el capítulo 15 del manual Cochrane que «Los autores de las revisiones deben evitar recomendaciones específicas que inevitablemente dependen de suposiciones sobre los recursos disponibles, los valores y las preferencias, y otros factores como las consideraciones de equidad, la viabilidad y la aceptabilidad de una intervención. El objetivo de la revisión debe ser presentar información y ayudar a su interpretación, más que ofrecer recomendaciones. La discusión y las conclusiones deben ayudar a las personas a comprender las implicaciones de las pruebas en relación con las decisiones prácticas y a aplicar los resultados a su situación específica. Los autores de la revisión pueden ayudar a esta comprensión de las implicaciones planteando diferentes escenarios que describan determinadas estructuras de valores». Cochrane y GRADE consideran que hacer recomendaciones para la práctica está fuera del alcance de una revisión sistemática y reservando las recomendaciones únicamente competencia de las guías de práctica clínica.
Por el contrario, la JBI sugiere que las recomendaciones pueden y deben incluirse también en las revisiones sistemáticas del JBI. Si consultamos su Manual (5), en el apartado de conclusiones se indica que «debe incluir las recomendaciones para la práctica inferidas de los resultados de la revisión e inferidas también sobre la base de la discusión sobre la generalizabilidad de los resultados y los factores potenciales que pueden afectar a la aplicabilidad de los resultados. A las recomendaciones se les debe asignar un Grado de Recomendación del JBI» (5).
BIBLIOGRAFÍA
- Liberati A, Altman DG, Tetzlaff J et al. The PRISMA Statement for Reporting Systematic Reviews and Meta-Analyses of Studies That Evaluate Health Care Interventions: Explanation and Elaboration. PLoS Med. 2009;6(7):e1000100.
- Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ 2021;372:n71. doi: 10.1136/bmj.n71
- Schünemann HJ, Vist GE, Higgins JPT, Santesso N, Deeks JJ, Glasziou P, Akl EA, Guyatt GH. Chapter 15: Interpreting results and drawing conclusions. In: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions version 6.4 (updated August 2023). Cochrane, 2023. Available from http://www.training.cochrane.org/handbook.
- Balshem H, Helfand M, Schunemann HJ et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011;64(4):401-6.
- Tufanaru C, Munn Z, Aromataris E, Campbell J, Hopp L. Chapter 3: Systematic reviews of effectiveness. Aromataris E, Munn Z, editors. JBI Manual for Evidence Synthesis. JBI; 2020. Disponible en: https://synthesismanual.jbi.global. https://doi.org/10.46658/JBIMES-20-04